Hauserbasen
Bei Hauserbasen, auch als Magnesiumamidbasen bezeichnet, handelt es sich um Magnesiumverbindungen, die in der organischen Chemie als Basen für Metallierungsreaktionen verwendet werden und erstmals 1947 von Charles R. Hauser beschrieben worden sind.[1] Im Vergleich zu lithiumorganischen Verbindungen haben diese Verbindungen kovalentere und damit weniger reaktive Metall–Ligand-Bindungen. Das führt in der Konsequenz zu einer höheren Toleranz gegenüber funktionellen Gruppen und einer deutlich höheren Chemoselektivität.[2] Außerdem können Hauserbasen für Reaktionen bei Raumtemperatur genutzt werden, wohingegen Reaktionen mit lithiumorganischen Verbindungen tendenziell bei tiefen Temperaturen, für gewöhnlich −78 °C, durchgeführt werden.
Struktur
Festkörperstruktur
Wie alle Grignard-Dimere[3] sind die von 2,2,6,6-Tetramethylpiperidin (TMP)[4] und Hexamethyldisilazan (HMDS)[5] abgeleiteten Hauserbasen im Festkörper durch die Halogene verbrückt. Im Gegensatz zu Grignardverbindungen existieren allerdings auch amidoverbrückte Hauserbasen. Dabei haben alle gemeinsam, dass sie durch sterisch weniger anspruchsvolle Amidoliganden wie Et2N−,[6] Ph3P=N−[7] oder iPr2N−[8] verbrückt sind. Der Austausch der Halogenbrücken hängt dabei wahrscheinlich mit dem sterischen Anspruch der Amidliganden zusammen.
-
TMP-basierte Hauserbase im Festkörper
-
HMDS-basierte Hauserbase im Festkörper
-
Diethylamido-verbrückte Hauserbase im Festkörper
Struktur in Lösung
Obwohl über die Möglichkeiten der Verwendung von Hauserbasen viel bekannt ist, ist über ihr Verhalten in Lösung nur wenig bekannt. Ein Grund dafür liegt in dem komplexen Verhalten, das sie in Lösung zeigen. Ein Vorschlag lautete, dass es Ähnlichkeiten zum Schlenk-Gleichgewicht der Grignardreagenzen gibt, bei denen mehr als eine magnesiumhaltige Spezies existiert.[9] 2016 konnten Neufeld et al. durch DOSY-NMR-Experimente[10] ein solches schlenkartiges Verhalten nachweisen:[11]
Das Gleichgewicht zeigt dabei eine hohe Temperaturabhängigkeit. So liegt bei hohen Temperaturen hauptsächlich die heteroleptische Spezies vor, bei niedrigen Temperaturen hingegen die homoleptischen Spezies. Außerdem finden sich in der THF-Lösung dimere Spezies, die durch Chloride und Amide verbrückt werden, obwohl Alkylmagnesiumchloride dort nicht dimerisieren. Bei niedrigen Temperaturen und einem Überschuss an Magnesiumchlorid finden sich in der Lösung außerdem noch MgCl2-co-koordinierende Spezies.[12]
Verwendung
Im Allgemeinen werden Hauserbasen genau wie Organolithiumverbindungen oder Metallamide als Metallierungsreagenzien verwendet. Der Durchbruch von Synthesevorschriften mit Hauserbasen erfolgte dabei in den 1980er und 1990er Jahren. Eaton und seine Mitarbeiter konnten zeigten, dass iPr2NMgBr selektiv in Orthoposition Magnesiatcarboxamide bildet.[13]
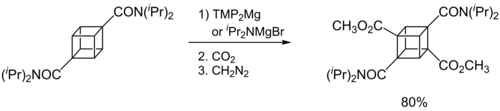
Später zeigten Kondo, Sakamo und ihre Mitarbeiter, dass iPr2NMgX (X= Cl, Br) als selektives Deprotonierungsreagenz (nur an der 2-Position) für heterocyclische Thiophene[14] und phenylsulphonylsubstituierte Indole dient.[15]


Ein großer Nachteil von Hauserbasen liegt in ihrer schlechten Löslichkeit in THF. In der Konsequenz ist die Metallierungsgeschwindigkeit gering und es wird ein großer Überschuss an Base benötigt (meistens 10 Äquivalente). Dieser Umstand verkompliziert die Funktionalisierung des metallierten Intermediats als Elektrophil. Die Löslichkeit und damit auch die Reaktivität kann allerdings durch das Zufügen von stöchiometrischen Mengen Lithiumchlorid erreicht werden. Diese sogenannten Turbo-Hauserbasen wie TMPMgCl·LiCl and iPr2NMgCl·LiCl sind teilweise kommerziell erhältlich[16] und zeigen eine erhöhte kinetische Basizität, eine exzellente Regioselektivität und eine hohe Toleranz gegenüber funktionellen Gruppen bei vielen aromatischen und heteroaromatischen Substraten.[17][18]
Darstellung
Hauserbasen können durch die Mischung eines Amins mit einem Grignardreagenz hergestellt werden (X = Cl, Br, I):
Kommerziell erhältliche Hauserbasen
iPr2NMgX
TMPMgX (TMP = 2,2,6,6,Tetramethylpiperidino)
X = Cl, Br
Siehe auch
Einzelnachweise
- ↑ Vorlage:Literatur
- ↑ Vorlage:Literatur
- ↑ Vorlage:Literatur
- ↑ Vorlage:Literatur
- ↑ Vorlage:Literatur
- ↑ Vorlage:Literatur
- ↑ Vorlage:Literatur
- ↑ Vorlage:Literatur
- ↑ Neufeld, Roman.: DOSY External Calibration Curve Molecular Weight Determination as a Valuable Methodology in Characterizing Reactive Intermediates in Solution. In: eDiss, Georg-August-Universität Göttingen. 2016.
- ↑ Vorlage:Literatur
- ↑ Vorlage:Literatur
- ↑ Vorlage:Literatur
- ↑ Vorlage:Literatur
- ↑ Vorlage:Literatur
- ↑ Vorlage:Literatur
- ↑ Vorlage:Internetquelle
- ↑ Vorlage:Literatur
- ↑ Vorlage:Literatur


